Hai selamat bertemu lagi
Aku sudah lama menghindarimu
Sialku lah kau ada di sini
Sungguh tak mudah bagiku
Rasanya tak ingin bernafas lagi
Tegak berdiri di depanmu kini
Sakitnya menusuki jantung ini
Melawan cinta yang ada di hati
Dan upayaku tahu diri tak selamanya berhasil
Pabila kau muncul terus begini
Tanpa pernah kita bisa bersama
Pergilah, menghilang sajalah lagi
Bye selamat berpisah lagi
Meski masih ingin memandangimu
Lebih baik kau tiada di sini
Sungguh tak mudah bagiku
Menghentikan segala khayalan gila
Jika kau ada dan ku cuma bisa
Meradang menjadi yang di sisimu
Membenci nasibku yang tak berubah
Dan upayaku tahu diri tak selamanya berhasil
Pabila kau muncul terus begini
Tanpa pernah kita bisa bersama
Pergilah, menghilang sajalah lagi
Berkali-kali kau berkata kau cinta tapi tak bisa
Berkali-kali ku telah berjanji menyerah
Dan upaya ku tahu diri tak selamanya berhasil
Dan upaya ku tahu diri tak selamanya berhasil
Pabila kau muncul terus begini
Tanpa pernah kita bisa bersama
Pergilah, menghilang sajalah
Pergilah, menghilang sajalah
Pergilah, menghilang sajalah lagi
Wednesday, 2 October 2013
ikatan logam
Logam atau
metal mememiliki beberapa karakter umum yaitu wujud padat, menunjukkan
kilap, massa jenis tinggi, titik didih dan titik lebur tinggi, konduktor
panas dan listrik yang baik, kuat atau keras namun mudah dibentuk
misalnya dapat ditempa (malleable) dan direnggangkan (ductile).
Walaupun demikian terdapat beberapa sifat yang menyimpang misalnya raksa
pada suhu kamar merupakan satu-satunya logam yang berwujud padat dan
hingga saat ini belum diketahui mengapa raksa berwujud cair.
Selain itu titik leleh beberapa unsur logam sangat rendah yaitu Hg, Cs
dan Rb dengan titik didih berturut-turut adalah -38,83 °C, 29°C dan 39°C
dan Li dan K memiliki massa jenis yang rendah yaitu 0,534 dan 0,86
g/mL.
Emas, perak dan platina disebut logam mulia, sedangkan emas, tembaga dan perak sering disebut sebagai logam mata uang, karena ketiga unsur ini dipadukan untuk membuat koin-koin mata uang. Dikatakan sebagai logam mulia karena ketiga logam ini sukar teroksidasi dengan sejumlah besar pereaksi.
Selain dikenal
logam mulia dikenal pula logam berat (heavy metal) adalah logam dengan
massa jenis lima atau lebih, dengan nomor atom 22 sampai dengan 92. Raksa, kadmium, kromium dan timbal merupakan beberapa contoh logam berat.
Logam-logam berat dalam jumlah yang banyak artinya melebihi kadar
maksimum yang ditetapkan, sangat berbahaya bagi kesehatan manusia karena
dapat menyebabkan kanker (bersifat karsinogen).
Ikatan Logam
Berdasarkan sifat umum logam dapat disimpulkan bahwa ikatan logam ternyata bukan merupakan ikatan ion maupun ikatan kovalen.
Ikatan logam didefinisikan berdasarkan model awan elektron atau lautan
elektron yang didefinisikan oleh Drude pada tahun 1900 dan disempunakan
oleh Lorents pada tahun 1923.
Berdasarkan
teori ini, logam di anggap terdiri dari ion-ion logam berupa bola-bola
keras yang tersusun secara teratur, berulang dan disekitar ion-ion logam
terdapat awan atau lautan elektron yang dibentuk dari elektron valensi
dari logam terkait.
Awan elektron
yang terbentuk berasal dari semua atom-atom logam yang ada. Hal ini
disebabkan oleh tumpang tindih (ovelap) orbital valensi dari atom-atom
logam (orbital valensi = orbital elektron valensi berada). Akibatnya elektron-elektron yang ada pada orbitalnya dapat berpindah ke orbital valensi atom tetangganya. Karena
hal inilah elektron-elektron valensi akan terdelokaslisasi pada semua
atom yang terdapat pada logam membentuk awan atau lautan elektron yang
bersifat mobil atau dapat bergerak.
pengertian tabel periodik
Tabel periodik unsur-unsur kimia adalah tampilan unsur-unsur kimia dalam bentuk tabel. Unsur-unsur tersebut diatur berdasarkan struktur elektronnya sehingga sifat kimia unsur-unsur tersebut berubah-ubah secara teratur sepanjang tabel. Setiap unsur didaftarkan berdasarkan nomor atom dan lambang unsurnya.
Tabel periodik standar memberikan informasi dasar mengenai suatu unsur. Ada juga cara lain untuk menampilkan unsur-unsur kimia dengan memuat keterangan lebih atau dari persepektif yang berbeda.
Tabel periodik standar memberikan informasi dasar mengenai suatu unsur. Ada juga cara lain untuk menampilkan unsur-unsur kimia dengan memuat keterangan lebih atau dari persepektif yang berbeda.
Categories
pelajaran
ikatan ion
Ikatan ion (atau ikatan elektrokovalen) adalah jenis ikatan kimia yang dapat terbentuk antara ion-ion logam dengan non-logam
(atau ion poliatomik seperti amonium) melalui gaya tarik-menarik
elektrostatik. Dengan kata lain, ikatan ion terbentuk dari gaya
tarik-menarik antara dua ion yang berbeda muatan.
Misalnya pada garam meja (natrium klorida). Ketika natrium (Na) dan klor (Cl) bergabung, atom-atom natrium kehilangan elektron, membentuk kation (Na+), sedangkan atom-atom klor menerima elektron untuk membentuk anion (Cl-). Ion-ion ini kemudian saling tarik-menarik dalam rasio 1:1 untuk membentuk natrium klorida.
Misalnya pada garam meja (natrium klorida). Ketika natrium (Na) dan klor (Cl) bergabung, atom-atom natrium kehilangan elektron, membentuk kation (Na+), sedangkan atom-atom klor menerima elektron untuk membentuk anion (Cl-). Ion-ion ini kemudian saling tarik-menarik dalam rasio 1:1 untuk membentuk natrium klorida.
- Na + Cl → Na+ + Cl- → NaCl
Categories
pelajaran
senyawa karbon
Kekhasan atom C (keistimewaan atom C) :

- Berdasar Elektron Valensinya, atom C dapat mengikat 4 atom atau gugus lain yang sejenis atau berbeda-jenis secara kovalen (mengikat dengan 4 garis ikatan kovalen).
- Antara atom C dapat saling berikatan membentuk rantai C dengan Ikatan tunggal maupun ikatan rangkap (rangkap 2 atau 3).
- Pada rantai C ada yang terbuka atau tertutup serta cabang.
- Pada rantai C dikenal adanya : Atom C primer, Atom C sekunder, Atom C tersier dan Atom

Persamaan reaksi
Dalam ilmu kimia, persamaan reaksi atau persamaan kimia adalah penulisan simbolis dari sebuah reaksi kimia. Rumus kimia pereaksi ditulis di sebelah kiri persamaan dan rumus kimia produk dituliskan di sebelah kanan.[1] Koefisien yang ditulis di sebelah kiri rumus kimia sebuah zat adalah koefisien stoikiometri,
yang menggambarkan jumlah zat tersebut yang terlibat dalam reaksi
relatif terhadap zat yang lain. Persamaan reaksi yang pertama kali
dibuat oleh ahli iatrokimia Jean Beguin pada 1615.
Dalam sebuah persamaan reaksi, pereaksi dan produk dihubungkan melalui simbol yang berbeda-beda. Simbol → digunakan untuk reaksi searah, ⇆ untuk reaksi dua arah, dan ⇌ untuk reaksi kesetimbangan. Misalnya, persamaan reaksi pembakaran metana (suatu gas pada gas alam) oleh oksigen dituliskan sebagai berikut
Suatu persamaan disebut setara jika jumlah suatu unsur pada sebelah kiri persamaan sama dengan jumlah unsur tersebut di sebelah kanan, dan dalam reaksi ionik, jumlah total muatan harus setara juga.
Dalam sebuah persamaan reaksi, pereaksi dan produk dihubungkan melalui simbol yang berbeda-beda. Simbol → digunakan untuk reaksi searah, ⇆ untuk reaksi dua arah, dan ⇌ untuk reaksi kesetimbangan. Misalnya, persamaan reaksi pembakaran metana (suatu gas pada gas alam) oleh oksigen dituliskan sebagai berikut
- CH4 + 2 O2 → CO2 + 2 H2O
- 2K (s) + 2H2O (l) → 2KOH (aq) + H2 (g)
Suatu persamaan disebut setara jika jumlah suatu unsur pada sebelah kiri persamaan sama dengan jumlah unsur tersebut di sebelah kanan, dan dalam reaksi ionik, jumlah total muatan harus setara juga.
hukum dasar kimia
LAVOISIER menyimpulkan bahwa : jika suatu reaksi kimia dilakukan di ruang tertutup sehingga tidak ada zat-zat yang hilang, maka
massa zat-zat sebelum reaksi dan sesudah reaksi tidak berkurang atau tidak bertambah ( tetap ).
dalam tabung tertutup ditimbang 32 gram belerang dan 63,5 gram tembaga. Setelah dicampur lalu dipanaskan dalam tabung tertutup dan reaksi berjalansempurna maka terjadi zat baru, yaitu tembaga ( II ) sulfida. Berapa massa zat baru tersebut ?
jawab :
ternyata massa zat baru tersebut sama dengan massa total zat-zat sebelum reaksi.
Bunyi Hukum Kekekalan Massa : ” JUMLAH MASSA ZAT-ZAT SEBELUM DAN SESUDAH REAKSI ADALAH SAMA “
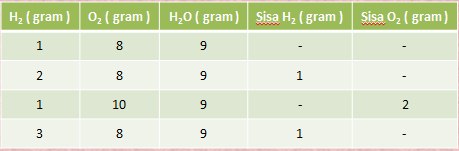
HUKUM PERBANDINGAN TETAP ( HUKUM PROUST )
Bunyi Hukum Perbandingan Tetap :
” DALAM SUATU SENYAWA, PERBANDINGAN MASSA UNSUR-UNSUR PENYUSUNNYA SELALU TETAP “
Pada percobaan 1 gram hidrogen dicampur dengan 8 gram oksigen hasilnya ialah 9 gram air. Dan ternyata 8 gram oksigen hanya dapat bereaksi dengan 1 gram hidrogen saja.
Jika kita mereaksikan 4 gram hidrogen dengan 40 gram oksigen, berapa gram air yang terbentuk?
jawab :
massa zat-zat sebelum reaksi dan sesudah reaksi tidak berkurang atau tidak bertambah ( tetap ).
dalam tabung tertutup ditimbang 32 gram belerang dan 63,5 gram tembaga. Setelah dicampur lalu dipanaskan dalam tabung tertutup dan reaksi berjalansempurna maka terjadi zat baru, yaitu tembaga ( II ) sulfida. Berapa massa zat baru tersebut ?
jawab :

ternyata massa zat baru tersebut sama dengan massa total zat-zat sebelum reaksi.
Bunyi Hukum Kekekalan Massa : ” JUMLAH MASSA ZAT-ZAT SEBELUM DAN SESUDAH REAKSI ADALAH SAMA “
HUKUM PERBANDINGAN TETAP ( HUKUM PROUST )
Bunyi Hukum Perbandingan Tetap :
” DALAM SUATU SENYAWA, PERBANDINGAN MASSA UNSUR-UNSUR PENYUSUNNYA SELALU TETAP “
Pada percobaan 1 gram hidrogen dicampur dengan 8 gram oksigen hasilnya ialah 9 gram air. Dan ternyata 8 gram oksigen hanya dapat bereaksi dengan 1 gram hidrogen saja.
Data Percobaan Hidrogen dan Oksigen
contoh soal :Jika kita mereaksikan 4 gram hidrogen dengan 40 gram oksigen, berapa gram air yang terbentuk?
jawab :

Subscribe to:
Comments (Atom)